Атом - инертный газ
Cтраница 1
Атомы инертного газа ионизируются в разряженном замкнутом пространстве и под действием разности потенциалов или импульсного высокочастотного поля ( например, трансформатор Тесла) внедряются в поверхность порошка. [1]
Атомы инертных газов, иногда называемых редкими или благородными, имеют на валентных уровнях по 8 электронов, за исключением гелия, у которого всего 2 электрона. Все элементы этой группы в свободном виде - низкокипящие вещества, физические свойства которых весьма закономерно изменяются с увеличением заряда ядра атома. Из всех известных веществ гелий имеет самую низкую точку кипения. Вследствие монотонного увеличения теплоты парообразования точки кипения инертных газов закономерно возрастают с увеличением порядкового номера. [2]
Атомы инертных газов стабильны, а атомы всех других элементов нестабильны. Атом натрия имеет один валентный электрон, а атом хлора имеет семь валентных электронов. [3]
Атомы инертных газов взаимодействуют между собой лишь за счет дисперсионных сил. Энергия дисперсионного взаимодействия возрастает в ряду Не-Rn в связи с увеличением радиуса атомов и как следствие увеличения их поляризуемости. [4]
Атомы инертных газов, имеющих законченные внешние электронные оболочки, притягиваются друг к другу лишь слабыми ван-дер-ваальсовыми силами, возникающими в результате смещения электронов при сближении атомов. Решетки их, благодаря сферической симметрии электрических полей так же, как и у большинства металлов, пяотноупакованные, а именно: плотноупа-кованная гексагональная у гелия и гране-центрированная кубическая у остальных инертных газов. Слабая молекулярная связь между атомами объясняет очень малую прочность решеток. [6]
Атомы инертных газов имеют полностью достроенные энергетические уровни, а поэтому при сближении атомов обмен электронами невозможен. [7]
Атомы инертных газов обладают дипольным моментом. [8]
 |
Схемы электронных конфигураций гелия и неона.| Электронная конфигурация молекулы воды. [9] |
Атомы инертных газов I и II периодов отвечают законченным электронным конфигурациям внешнего электронного слоя, имеющего заполненными все вакансии. [10]
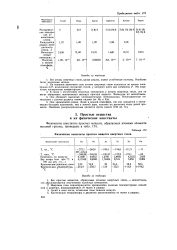 |
Физические константы простых веществ инертных газов. [11] |
Все атомы инертных газов, кроме радона, имеют устойчивые изотопы. [12]
Положение атомов инертных газов в кристаллических решетках металлов освещено в литературе недостаточно. Риммер и Коттрелл [75] провели расчет типов твердых растворов, являющихся энергетически более выгодными. Согласно этим расчетам, большинство инертных газов образует растворы замещения, тогда как гелий может образовывать либо растворы замещения, либо растворы внедрения. [13]
Накопление атомов инертного газа в матрице, происходящее при облучении пленок Ni - SiO ионами Аг4, должно приводить к изменению механизма порообразования. Иными словами, в этом случае механизм порозарождения аналогичен рассмотренному выше. Однако продолжающееся при облучении накопление аргона в пленке неизбежно приведет к уменьшению концентрации свободных вакансий вследствие образования аргон-вакансионных комплексов и, следовательно, уменьшению относительной доли пор вакансионной природы. Ранее отмечалось [204], что влияние аргона на процессы зарождения и роста пор зависит от температуры облучения: при относительно низкой температуре ( 500 С) основной вклад в распухание вносят вакансионные поры, тогда как роль газонаполненных пор растет с увеличением температуры и становится преобладающей при 650 С. [14]
Валентность атомов инертных газов ( Ne, Ar, Kr, Xe, Rn), имеющих на внешней оболочке восемь электронов, равна нулю, так как в химические реакции с другими элементами они не вступают. К этой же группе относится гелий, имеющий на внешней оболочке два электрона. [15]
Страницы: 1 2 3 4
