Атом - инертный газ
Cтраница 4
 |
Схема водородной связи в димере воды. J - ионная водородная можмолеку-лярная связь. 2 - ковалект-ная связь Н - О. [46] |
Экс и мерные М.в. Атомы инертных газов ( и нек-рых др. элементов, напр. Hg) в возбужденном состоянии проявляют свойства, сходные со свойствами атомов щелочных металлов. [47]
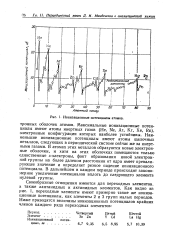 |
Ионизационные потенциалы атомов. [48] |
Максимальные ионизационные потенциалы имеют атомы инертных газов ( Не, Ne, Аг, Кг, Хе, Rn), электронные конфигурации которых наиболее устойчивы. Наименьшие ионизационные потенциалы имеют атомы щелочных металлов, следующих в периодической системе сейчас же за инертными газами. В атомах этих металлов образуются новые электронные оболочки, и хотя на этих оболочках помещаются только единственные s - электроны, факт образования новой электронной группы на более далеком расстоянии от ядра имеет превалирующее значение и определяет резкое падение ионизационного потенциала. В дальнейшем в каждом периоде происходит закономерное увеличение потенциалов вплоть до следующего элемента нулевой группы. [49]
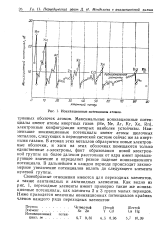 |
Ионизационные потенциалы атомов. [50] |
Максимальные ионизационные потенциалы имеют атомы инертных газов ( Не, Ne, Ar, Kr, Xe, Rn), электронные конфигурации которых наиболее устойчивы. Наименьшие ионизационные потенциалы имеют атомы щелочных металлов, следующих в периодической системе сейчас же за инертными газами. В атомах этих металлов образуются новые электронные оболочки, и хотя на этих оболочках помещаются только единственные s - электроны, факт образования новой электронной группы на более далеком расстоянии от ядра имеет превалирующее значение и определяет резкое падение ионизационного потенциала. В дальнейшем в каждом периоде происходит закономерное увеличение потенциалов вплоть до следующего элемента нулевой группы. [51]
Такие электронные структуры имеют атомы инертных газов, и это является причиной их инертности. Атомы других элементов при образовании химических связей стремятся приобрести такие электронные структуры. [52]
 |
Видимый спектр водорода ( серия Бальмера. [53] |
Но тогда должен получиться атом инертного газа. Рассматривая следующие за углеродом элементы, находим, что азот ( 2 и 5), кислород ( 2 и 6) и фтор ( 2 и 7) химически активны. Лишь элемент № 10 - неон - со структурой 2 и 8 оказывается инертным газом. Отсюда можно сделать вывод, что второй электронный слой становится устойчивым при 8 электронах. [54]
Чем характеризуются электронные оболочки атомов инертных газов. [55]
Янсена, при взаимодействии атомов инертных газов в какой-то степени также имеет место обмен валентными электронами. Так, в кристаллической решетке аргона на этот обмен приходится 0 1 % энергии связи. Такой обмен, как мы увидим ниже, характерен для ковалентного типа связи. [56]
Страницы: 1 2 3 4