Электроноакцептор-ной заместитель
Cтраница 2
Исследование большой серии замещенных в бензольном кольце этиловых зфиров а-броммеркурарилуксусных кислот102 105 позволило проследить влияние электронодонорных и электроноакцептор-ных заместителей в различных положениях бензольного кольца с целью разделения их полярного влияния на составляющие ( индукционный эффект и эффект сопряжения), а также выяснить возможность гиперконъюгации в данной системе. [16]
Последующие амино - или оксигруппы, вводимые в молекулу кра-сителей, являются уже электронодонорными или электроноакцептор-ными заместителями. [17]
Алкильные или фенильный заместители при двойной связи значительно облегчают реакцию, наличие сопряженной двойной связи или электроноакцептор-ных заместителей затрудняют ее. [18]
Наиболее убедительным доказательством этого является сдвиг максимума поглощения при 440 нм в более длинноволновую область у сильных электроноакцептор-ных заместителей. Дело в том, что этот максимум приписывается d - d - переходу между уровнями, локализованными в основном на атоме железа и, следовательно, не поддающимися влиянию заместителей в кольце. Для большинства заместителей сдвиги действительно не превышают 3 - 4 нм. У сильных акцепторных заместителей сдвиги достигают десятков нанометров. [19]
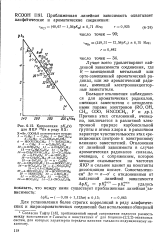 |
Корреляция p / Ca ( v. [20] |
Лучше всего удовлетворяют найденной зависимости соединения, где R - замещенный метальный или орто-замещенный ароматический радикал, или же ароматический радикал, имеющий электроноакцептор-ные заместители. [21]
Заместитель R в алкильной части оказывает влияние, противоположное наблюдаемому на первой стадии: электронодонорные заместители уменьшают положительный заряд карбонильной группы из-за подачи электронов к углеродному атому этой группы и вследствие этого замедляют третью стадию, а электроноакцептор-ные заместители ускоряют ее. [22]
В спектрах Н - ЯМР ароматических альдегидов на химические сдвиги альдегидного протона оказывают влияние два противоположных фактора: 1) дезэкранирующий эффект ароматического кольца и 2) конъюгативный экранирующий эффект увеличения электронной плотности на карбонильном углеродном атоме. Электроноакцептор-ные заместители в ароматическом кольце увеличивают деззкрани-рование. Для орто-замещенных альдегидов сигнал альдегидного протона наблюдается в значительно более слабом поле, возможно в результате выведения формильной группы из плоскости молекулы и уменьшения тем самым конъюгативного экранирующего эффекта. [23]
Электронодонорные заместители, увеличивающие электронную плотность ароматического ядра, и галогены, так называемые з а-местители первого рода, направляют вступающую группу преимущественно в орто - и пара-положение. Электроноакцептор-ные заместители, уменьшающие электронную плотность ароматического ядра ( кроме галогенов), так называемые заместители второго рода, направляют вступающую группу преимущественно в мета-положение. [24]
Введение электроноакцептор-ных заместителей в фенилазогруппу молекулы 1-фенилазонаф-тола - 2 ( 35а) или 4-фенилазонафтола - 1 ( 37а) сдвигает равновесие в сторону хиноидной формы, а введение электронодонорных знместителей - в противоположном направлении. [25]
Активность катиона диазония в реакции азосочетания сильно зависит от заместителей в ароматическом кольце, хорошо коррели-руясь с их 0-константами Гаммета. При этом электроноакцептор-ные заместители, увеличивая дробный положительный заряд на концевом атоме азота, повышают активность соли диазония как электрофильного агента. [26]
Скорость диазотирования аминов зависит от их строения, характера заместителей и природы анионов кислот, участвующих в реакции. Амины, содержащие в ароматическом ядре электроноакцептор-ные заместители ( NO, SO3H, COOH, C1 и др.), например 2 4-динитро - 1-нафтиламин, диазотируются быстро и почти нацело. [27]
Однако выход в этой реакции невелик. В молекулу 1 3 5-бензол-трисульфокислоты не удается ввести уже более никаких электроноакцептор-ных заместителей. [28]
Илиды являются нуклеофильными реагентами, причем их активность обратно пропорциональна их стабильности. Стабилизация илидов достигается за счет делокали-зации электронной плотности под действием электроноакцептор-ных заместителей у карбаниона. [29]
Таким образом, из знаков коэффициентов р ясно, что энергию перехода vi понижают электронодонорные заместители и переход, следовательно, должен быть связан с электронным переносом из аминного ядра азометина в альдегидное. Наоборот, переходу v благоприятствуют в смысле снижения требуемой энергии возбуждения электроноакцептор-ные заместители. Следовательно, электронный переход обусловлен переносом в сторону аминного кольца. [30]
Страницы: 1 2 3 4