Электронный заряд
Cтраница 2
Ускорение электронных зарядов может вызвать испускание фотона. [16]
 |
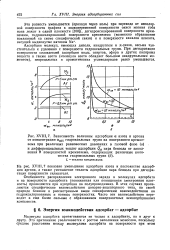
Строение итс-связи АА. [17] |
Плотность электронного заряда в облаке распределяется симметрично между концами и оказывается наибольшей вблизи каждого из атомов и в узкой перемычке между этими двумя областями. [18]
 |
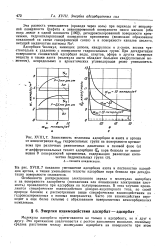
Зависимость полной Е, кинетической Т и потенциальной V энергий от межъядерного расстояния R в молекуле Н2. [19] |
Повышение электронного заряда на связи, в свою очередь, приводит к понижению потенциальной энергии V. Заметим, что все эти процессы происходят одновременно. Теорема вириала выступает здесь в роли регулятора, поддерживая все время необходимое равновесие между Т и V, не допуская неограниченного увеличения или уменьшения одной из величин. [20]
Изменение электронного заряда Qn обусловлено тремя причинами базовым током, рекомбинацией в базе и электронными составляющими токов / э и / к. Последние всегда отрицательны, так как в процессе инжекции электроны у х о д я т из базы. Рекомбинацией-ный ток тоже отрицателен, так как рекомбинация приводит к уменьшению числа электронов. Поскольку речь идет о рекомбинации неравновесных электронов, из формулы ( 1 - 516), интегрируя по объему, легко получить для этого тока значение - AQn / t, где AQn - неравновесный заряд электронов. [21]
Изменение электронного заряда Qn обусловлено тремя причинами: базовым током, рекомбинацией в базе и электронными составляющими токов / э и / к. Последние всегда отрицательны, так как в процессе инжекции электроны уходят из базы. Рекомбинационный ток тоже отрицателен, так как рекомбинация приводит к уменьшению числа электронов. Поскольку речь идет о рекомбинации неравновесных электронов, из формулы ( 1 - 516), интегрируя по объему, легко получить для этого тока значение - AQn / T, где AQn - неравновесный заряд электронов. [22]
Следовательно, электронный заряд, связанный с избыточным электроном, может в случае иодид-нона поляризовать остальную часть электронной оболочки атома легче, чем в случае других галогенов. Это сопряжено с понижением энергии. В случае сульфогруппы внутренняя стабилизация путем делокализации электронного заряда на сульфогруппе выражена еще сильнее и, кроме того, зависит также от других имеющихся в молекуле электрофильных заместителей, которые дополнительно стабилизируют образующийся анион. [23]
Именно существованием электронных зарядов на конечных атомах в бутадиене и его аналогах, а особенно возможностью повышения концентрации зарядов в этих местах при возбуждении молекулы, и объясняется существование реакций, называемых диеновым синтезом. [24]
Способ нахождения электронных зарядов в зонах атомов и связей был с теоретической точки зрения подвергнут критике также Моффитом. [25]
Для расчета электронных зарядов в соединениях типа толуола и пропилена псевдоатом Н3 и связанный с ним углерод метальной группы рассматривают так, как будто они являются донорами it - электронов. Таким образам, при расчете принимается, например, для молекулы пропилена не два, а четыре я-электрона. [26]
Распределение плотности электронного заряда в таких молекулах довольно сложно. В них обнаруживаются точки и с повышенной и с пониженной электронной плотностью. Некоторые орбиты могут быть и свободными, и тогда на них при соответствующих условиях могут перейти электроны от другой частицы. Частица, отдающая электрон, называется донором, а частица, принимающая электрон - акцептором. [27]
Особенности распределения электронного заряда в молекулах адсорбата и на поверхности адсорбента ( пониженная или повышенная электронная плотность) проявляются при адсорбции на полупроводниках. В этих случаях проявляются специфические взаимодействия донорно-акцепторного типа, по своей природе близкие к рассмотренным выше специфическим взаимодействиям на гидроксилированных и ионных поверхностях. Часто эти взаимодействия переходят в еще более сильные с образованием поверхностных хемосорбционных комплексов. [29]
Страницы: 1 2 3 4