Насыщенный аналог
Cтраница 2
Алкенилсиланхлориды, алкенилалкоксисиланы и алкенилацилокси-силаны, подобно своим насыщенным аналогам, подвержены тем же реакциям гидролиза водой. В зависимости от условий гидролиза образуются или линейные, или циклические полисилоксаны, либо алкенил-силанолы. Однако значительно проще получать соответствующие силанолы и силан-диолы гидролизом ацетоксипроизводных алкенилсиланов. [16]
Это соединение сольволизируется в 1011 раз быстрее, чем насыщенный аналог, и при этом наблюдается сохранение конфигурации. В данном случае размещение л-электронов идеально подходит для осуществления Ti-содействия. [17]
В этих условиях ненасыщенные глицериды не отделяются от их насыщенных аналогов, но можно легко разделить глицериды, различающиеся на два углеродных атома. Иногда удается даже разделить глицериды, различающиеся всего на один атом углерода. Новые жидкие силоксановые фазы с повышенной полярностью и умеренной термостабильностью позволяют разделять смеси нейтральных липидов по их молекулярной массе и степени ненасыщенности. [18]
Примечание; AJ - разность индексов удерживания олефина и его насыщенного аналога ( значения I для октанов см. в табл. II. [19]
Алкены за счет двойной связи более стабильны по сравнению с соответствующими насыщенными аналогами. Более симметричное ( центральное) положение двойной связи повышает стабильность молекулы. [20]
Аллильные катионы и анионы стабилизированы сильнее по сравнению с их полностью насыщенными аналогами ( Сайке, ее. Поэтому известно аллильное окисление нескольких типов, в которых в качестве интермедиатов участвуют аллильные радикалы, катионы или анионы. Естественно, что при этом конкурирующим процессом является окисление двойной связи, а сами интермедиа-ты могут подвергаться реакциям по другому концу аллиль-ной системы. [21]
Ненасыщенные алифатические полигалогениды обладают более стабильными М -, чем их насыщенные аналоги. Например, в масс-спектрах моно -, ди -, три - и тетрафторэтиленов пики М почти всегда ( кроме CF2CF2) имеют максимальную интенсивность. [22]
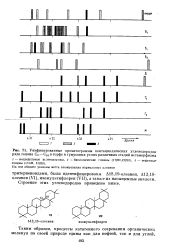 |
Унифицированные хроматограммы пентациклических углеводородов ряда гопана С2 - С33 в торфе и гумусовых углях различных стадий метаморфизма. [23] |
VI), изомультифлорен ( VII), а также их насыщенные аналоги. Строение этих углеводородов приведено ниже. [24]
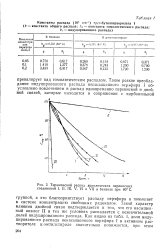 |
Термический распад ациклических перекисных соединений I, II, III, V, VI и VII в бензоле при 80 С. [25] |
Такой характер влияния двойной связи подтверждается и тем, что его насыщенный аналог II в тех же условиях распадается с незначительной долей индуцированного распада. [26]
Так как при переходе от ненасыщенных окси - К-гетероциклов к их насыщенным аналогам и ациклическим амидам устойчивость амидной структуры должна возрастать в результате отсутствия стабилизации изомерной формы резонансом в ароматическом цикле, то представляется маловероятным, что отсутствие указанной выше полосы в области 1600 - 1 / OU см связано с наличием в кристаллическом состоянии лактимной формы фенилртутного производного. Скорее всего это вызвано сильным смещением полосы амидной карбонильной группы в результате координации в кристаллической решетке атома металла с кислородом лактамного или амидного карбонила. [27]
В случае ненасыщенных алифатических эфиров наряду с процессами, характерными для их насыщенных аналогов, встречаются специфические реакции, обычно связанные с водородными перегруппировками. [28]
Ненасыщенные соединения на колонках, заполненных полиэфиром, удерживаются дольше, чем их насыщенные аналоги, благодаря более сильному взаимодействию растворенного вещества с растворителем - - - между более полярным растворенным веществом и полиэфиром. [29]
Анилин ( рКа 4 6) как основание значительно слабее, чем его насыщенный аналог ( циклогексиламин) или алифатические основания. [30]
Страницы: 1 2 3 4