Электрокапиллярное измерение
Cтраница 3
Деванатханом и Фернандо [67] по данным электрокапиллярных измерений в растворах иодидов тетраалкиламмония были рассчитаны величины адсорбции ионов [ ( CH3) 4N ], [ ( C2H3) 4N ], [ ( C3H7) 4N ], а также I в зависимости от заряда ртутного электрода и концентрации соли. Неожиданным результатом этой работы является независимость адсорбции ионов [ ( CH3) 4N ] и 1 - от концентрации соли [ ( CH3) 4N ] I, хотя оба эти иона обладают специфической адсорбируемостью на поверхности ртути. Авторы объясняют этот результат взаимным влиянием ионов [ ( CH3) 4N ] и I, образующих в двойном слое анионные и катионные мостики, однако такое объяснение вызывает сомнения. [31]
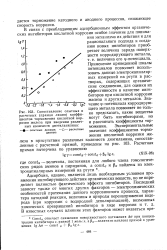 |
Сопоставление опытных и расчетных ( прямая линия коэффициентов торможения кислотной коррозии железа при введении различных количеств диэтиланилина. [32] |
Применение приведенной шкалы потенциалов позволяет использовать данные электрокапиллярных измерений на ртути в растворах, содержащих органические соединения, для оценки их эффективности в качестве ингибиторов при кислотной коррозии железа и других металлов. [33]
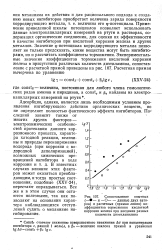 |
Сопоставление опытных ( - - и - О - - - - - - данные двух авторов и расчетных ( прямая линия коэффициентов торможения кислотной коррозии железа при введении разных количеств диэтиланилина. [34] |
Применение приведенной шкалы потенциалов позволяет использовать данные электрокапиллярных измерений на ртути в растворах, содержащих органические соединения, для оценки их эффективности в качестве ингибиторов при кислотной коррозии железа и других металлов. Значение ф-потенциала корродирующего металла позволяет не только предсказать, какие вещества могут быть ингибиторами, щ и рассчитать коэффициенты торможения. [35]
Применение приведенной шкалы потенциалов позволяет использовать данные электрокапиллярных измерений на ртути в растворах, содержащих органические соединения, для оценки их эффективности в качестве ингибиторов при кислотной коррозии железа и других металлов. Значение ср-потенциала корродирующего металла позволяет не только предсказать, какие вещества могут быть ингибиторами, но и рассчитать коэффициенты торможения. [36]
Применение приведенной шкалы потенциалов позволяет использовать данные электрокапиллярных измерений на ртути в растворах, содержащих органические соединения, для оценки их эффективности в качестве ингибиторов при кислотной коррозии железа и других металлов. Значение ф-потенциала корродирующего металла позволяет не только предсказать, какие вещества могут быть ингибиторами, но и рассчитать коэффициенты торможения. [37]
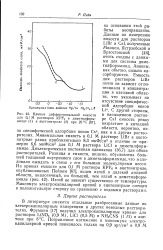 |
Кривые дифференциальной емкости. [38] |
В литературе имеются отдельные разбросанные данные по электрокапиллярным измерениям в других неводных растворителях. Фрумкин [17] получил электрокапиллярные кривые для растворов LiNOa ( 0 9 М), LiCl ( 0 5 М) и NH4CNS ( I M) в ацетоне при 8 С. [39]
Это позволяет определять защитное действие ингибиторов по данным электрокапиллярных измерений. [40]
Так как наклон у может быть определен из электрокапиллярных измерений, то для оценки ингибирующего действия данного вещества в широких пределах концентраций достаточно определить величину К всего лишь при одной какой-либо концентрации ингибитора. На рис. 8 показана проверка этого метода на примере двух ингибиторов - антраниловой кислоты и иодида ( триметилсшшлметил) диэтилбутиламмония. Как следует из рис. 8, расчетная прямая достаточно хорошо совпадает с опытными точками, полученными при непосредственном определении коррозионных потерь. [41]
Если бы не это благоприятное обстоятельство, результаты ранних электрокапиллярных измерений также были бы искажены в результате загрязнения электродов. В ранних измерениях емкости из-за ускорения адсорбции вследствие значительной конвекции у ртутного электрода в виде лужицы ошибка сильно возрастала. [42]
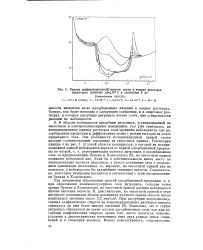 |
Кривые диффйренциальной емкости ртути в водных растворах перхлората тропилия при 200 С и амплитуде 8 мв. [43] |
В области потенциалов адсорбции дитропила, устанавливаемой по емкостным и электрокапиллярным измерениям, как уже отмечалось, на поляризационных кривых растворов соли тропилия наблюдаются три адсорбционные предволны и диффузионная волна с резким выходом на плато предельного тока. Эти особенности поляризационной кривой также находят соответствующее отражение на емкостных кривых. Зумана и Ходковского [5], на емкостной кривой возникает небольшой пик. Если бы в действительности имела место не переориентация молекул дитропила, а просто утолщение слоя с сохранением ориентации ( наслоение), то, вероятно, на емкостной кривой пик не появился, а наблюдалось бы дальнейшее снижение емкости. Следовательно, емкостные измерения находятся в соответствии с этим предположением Зумана и Ходковского. [44]
Адсорбируемость органических соединений на ртути, исследованная при помощи электрокапиллярных измерений, зависит от полярных свойств заместителей в ароматическом ядре молекулы. Установлена линейная зависимость между снижением поверхностного натяжения ртути Ду и константами Гаммета о для соответствующих заместителей. [45]
Страницы: 1 2 3 4 5