Активность - ион - хлор
Cтраница 1
Активность иона хлора при данной температуре постоянна, вследствие наличия избытка хлористого калия. Так как и каломель имеется в избытке, то активность ионов одновалентной ртути ( определяющая потенциал электрода) остается также постоянной. Поэтому пропускание слабых токов в любом направлении не влияет на потенциал электрода. [1]
Активность ионов хлора, по-видимому, можно объяснить высокой плотностью заряда и его легкой миграцией, конкурируя с частицами окислителя, этот ион включается в пассивную пленку, вызывая дефекты решетки, что уменьшает удельное сопротивление окисла. [2]
 |
Каломельный электрод. [3] |
Так как активность ионов хлора в растворе остается во время работы элемента постоянной, то потенциал электрода также остается постоянным. [4]
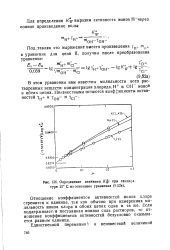 |
Определение величины Kfy при температуре 25 С на основании уравнения ( 9 52а. [5] |
Отношение коэффициентов активностей ионов хлора стремится к единице, так как обычно при измерениях мо-ляльность ионов хлора в обоих цепях одна и та же. Если поддерживается постоянная ионная сила растворов, то отношение коэффициентов активностей безусловно оказывается равным единице. [6]
Наоборот, изменение активности ионов хлора вполне отвечает изменению количества воды при замене части ее сахаром. Но так как и в этом случае сахар гидратирован, то мы должны признать, что ионы растворимы в гидратной воде сахара. [7]
Зависимость потенциала хлорсеребряного электрода от активности ионов хлора может быть выведена следующим образом. [8]
Как видно, потенциал хлорсеребряного электрода определяется активностью иона хлора в растворе. Потенциал электрода второго рода, вообще говоря, зависит от активности аниона малорастворимого соединения, входящего в состав электрода. [9]
Как видно, потенциал хлорсеребряного электрода определяется активностью иона хлора в растворе. Вообще говоря, потенциал электрода второго рода зависит от активности аниона малорастворимого соединения, входящего в состав электрода. [10]
Можно положить условно для всех чисто хлоридных расплавов активность ионов хлора равной единице и считать потенциал хлорного электрода при Pci2 l атм равным нулю. [11]
Таким образом, потенциал каломельного электрода зависит от активности иона хлора, так как электрод является обратимым относительно ионов хлора. [12]
Таким образом, потенциал каломельного электрода зависит от активности иона хлора, так как электрод является обратимым относительно ионов хлора. [13]
Определение рН из этих значений потенциала требует оценки коэффициента активности иона хлора. Некоторые исследователи для оценки УСГ предпочитают использовать теоретическое выражение для коэффициента активности отдельного иона. Для растворов с ионной силой, меньшей 0 1 М, ошибка эксперимента - величина того же порядка, или большая, чем различия, обусловленные различием методики оценки YCI - Последнее означает, что рН стандартного буферного раствора можно определить достоверно, если раствор не слишком концентрированный. [14]
Следовательно, потенциал этого электрода должен также однозначно определяться активностью ионов хлора. [15]
Страницы: 1 2 3 4