Активность - ион - хлор
Cтраница 3
Этот прием дает овзможность определить величину раН с такой точностью, с какой возможна оценка величины коэффициентов активности иона хлора. [31]
 |
Соединения фосфороксихлорида с хлоридами. [32] |
Реакции нейтрализации могут проводиться также с помощью цветных индикаторов: они показывают обратимое изменение цвета в зависимости от активности ионов хлора в растворе, которая может быть измерена также при помощи обратимого хлоридного электрода. [33]
Если оба вспомогательных электрода ( внешний и внутренний) находятся в контакте с насыщенным раствором хлорида калия, отношение активностей иона хлора, вероятно, изменяется незначительно с изменением температуры, несмотря на то, что внутренний раствор содержит также буферные вещества. [34]
Классическим примером в этом направлении является гипотеза Мак-Иннеса [139], согласно которой в водных растворах хлорида калия коэффициент активности иона калия равен коэффициенту активности иона хлора. Альтернативой гипотезы Мак-Иннеса является гипотеза Гуггенгейма [141, 142], который совершенно формально принял, что в бинарных смесях электролит - вода индивидуальные коэффициенты активности ионов равны среднегеометрическому коэффициенту активности электролита. [35]
В формальном отношении, прежде всего, поразительна аналогия между хлоридами и водой: там - водородные мостики, переходы ионов водорода, активность ионов водорода, здесь - хлоридные мостики, переходы ионов хлора, активность ионов хлора. [36]
Из уравнений ( VII43) и ( VII42) видно, что при увеличении активности ионов хлора С1 - или при уменьшении активности ионов ртути Hgi потенциал каломельного электрода становится более отрицательным. Активность ионов хлора С1 -, а значит и ионов Hgl зависит от концентрации хлористого калия в растворе. Обычно, пользуются растворами трех концентраций хлористого калия: 0 1; 1 0 кн. и насыщенным. [37]
Обычно в качестве электродов сравнения используют каломельный и хлорсеребряный электроды ( с. Потенциалы этих электродов определяются активностью ионов хлора. [38]
 |
Гребенчатый катод. [39] |
Состав раствора характеризуется начальной концентрацией исходного хлорида, рН анолита, концентрацией щелочи и хлорида в электролитическом щелоке, вытекающем из электролизера, а также содержанием принесена рассоле, подаваемом на электролиз. При повышении концентрации хлорида натрия возрастает активность ионов хлора, увеличивается доля тока на выделение хлора на аноде и уменьшается доля тока на выделение кислорода. Кроме того, с ростом концентрации хлорида натрия уменьшается растворимость хлора в анолите и количество его, попадающее в католит и реагирующее с образованием гипохлорита. [40]
Анионы могут быть определены в растворе, насыщенном солью с тем же анионом; катионом в этом случае должен быть ион металла, из которого сделан электрод. Например, хлорсеребряный электрод применен для определения активности ионов хлора в ячейке, приведенной на рис. II. [41]
В то время как соляная кислота стабилизирует низкомолекулярные гидрозоли кремнекислоты в случае, если она применяется в надлежащей концентрации, азотная кислота не стабилизирует эти золи; это довольно неожиданное свойство объяснил Турки14 образованием неустойчивых промежуточных соединений. Электропроводность гидрозолей НО1 - кремнекислота и потенциометричеокие измерения активности ионов хлора до и после дистилляции с концентрированной серной кислотой соответствует этому предположению. В своем эксперименте Турки использовал синтетический чистый NaiSiOs - aq, осажденный из раствора при помощи спирта, растворенного в воде, в отсутствие углекислого газа. [42]
Затруднение при подсчетах по этому уравнению состоит в том, что мы не знаем коэффициентов активности отдельно ионов хлора. Обычно средний коэффициент активности хлористого калия принимают за коэффициент активности ионов хлора. [43]
VI при определении средних активностей, могла бы быть получена активность ионов хлора при различных концентрациях. Однако активности, определенные таким образом, не являются активностями отдельных ионов. Действительно, они являются сложными функциями чисел переноса и активностей всех ионов, присутствующих в растворе, включая и те, которые находятся в солевом мостике, служащем для устранения диффузионного потенциала. [44]
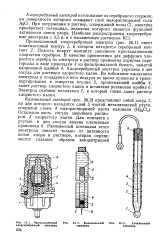 |
Промышленный хлорсеребряный электрод. [45] |
Страницы: 1 2 3 4