Активность - реагент
Cтраница 3
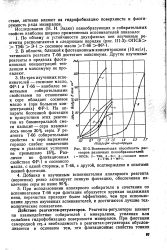 |
Вспенивающая способность растворов различных пенообразователей. [31] |
В области, близкой к флотационным концентрациям ( Южг / л), активность реагента Т-66 достигает максимума. Другие изученные реагенты в пределах флотационных концентраций тенденции к максимуму не проявляют. [32]
В этом уравнении от температуры существенно зависят стандартный потенциал Е и множитель RTInF; активности реагентов обычно мало изменяются при изменении температуры. [33]
В зависимости от природы аниона образуется более или менее полярная связь N-Y и меняется активность нитрующего реагента. Самыми активными солями нитрония являются соли с анионами BF r, SbFr, PF6, в которых существует свободный катион нитрония. Катион N02 имеет линейную структуру. [34]
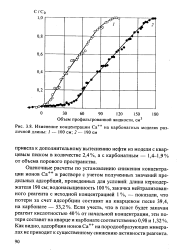 |
Изменение концентрации Са на карбонатных моделях различной длины. / - 100 2 - 190 см. [35] |
Как видно, адсорбция ионов Са на породообразующих минералах не приводит к существенному снижению активности реагента. [36]
В этом уравнении уФ - коэффициент активности переходного состояния, произведение берется по коэффициентам активности реагентов, k - предельное значение, к которому стремится k, когда концентрации всех участвующих в реакции растворенных веществ приближаются к нулю. Закономерности равновесия между ионами легко наблюдаемы потому, что можно предсказать коэффициенты активности ионов в разбавленном растворе. [37]
Уравнение ( 11) является основным соотношением, описывающим изменение электродного потенциала в зависимости от активностей реагентов и продуктов. Однако его применение к практическим системам часто бывает затруднительным из-за нехватки данных относительно коэффициентов активности веществ, от которых зависит потенциал. Рассмотрим, например, определение ферро-ферри редокс-потенциала при 25 С в растворе хлористого железа и хлорного железа в соляной кислоте, все при молялыюсти 0 01 моль / кг. [38]
Последнее соотношение служит одновременно определением величины / Са - константы равновесия химической реакции, выраженной через активности реагентов. [39]
Простой зависимости ( такой, какая дается уравнением Нернста) между смешанным потенциалом и концентрациями или активностями реагентов не наблюдается. Здесь имеет значение скорость переноса электронов, а также скорость переноса реагентов к поверхности и от поверхности электрода ( см. разд. [40]
Для реакций в тазовой фазе воздействие давления зависит от направления изменения числа молей и от значений коэффициентов активности реагентов и продуктов реакции. [41]
Для реакций в газовой фазе воздействие давления зависит от направления изменения числа молей и от значений коэффициентов активности реагентов и продуктов реакции. [42]
Следовательно, можно прийти к заключению, что переход от орто - к пара-сочетанию связан с увеличением активности реагента. [43]
Преобладание того или иного фактора по схеме ( Д) зависит каждый раз от условий окисления и отнбсительной активности реагентов. [44]
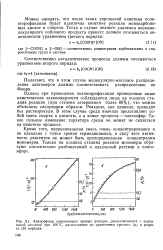 |
Анаморфозы кинетических кривых реакции диэтиленгликоля с адипи новой кислотой при 166СС, рассчитанные по уравнениям третьего ( а и второго ( б порядка. [45] |
Страницы: 1 2 3 4