Каталитическая активность - кислота
Cтраница 2
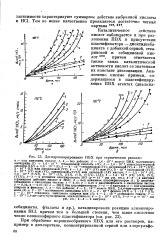
Таким образом, экспериментальные результаты, полученные в настоящей работе, по зависимости каталитической активности кислот от их силы, вполне корреспондируются с имеющимися данными по состоянию кислот-катализаторов в растворах аминов. [16]
Во многих случаях это явление может быть объяснено с количественной точностью, если принять, согласно Гаммету, за меру каталитической активности кислот так называемую функцию кислотности среды. [17]
Каталитическое действие кислот наблюдается и при разложении ПВХ в присутствии пластификатора - диоктилсеба-цината с добавкой серной, стеариновой и себациновой кислот 30, причем отмечается также связь каталитической активности кислот со значением их констант диссоциации. [19]
Дальнейшие исследования каталитической активности кислот к оснований привели к так называемой дуалистической теории катализа, разработанной Селтером, Лапвортом, Дау-сеном, Лаури и др. Согласно этой теории, каталитическая активность кислот не может быть приписана только иону водорода, а оснований - иону гидроксила, наряду с ионами водорода каталитически активны и недиссоциированные кислоты. Отсюда следовало, что диссоциация с выделением водорода не определяет кислотных свойств вещества. [20]
Дальнейшие исследования каталитической активности кислот и оснований привели к так называемой дуалистической теории катализа, разработанной Селтером, Лапвортом, Даусеном, Лаури и др. Согласно этой теории, каталитическая активность кислот не может быть приписана только иону водорода, а оснований-иону гидроксила, наряду с ионами водорода каталитически активны и недиссоциированные кислоты. Отсюда следовало, что диссоциация с выделением водорода не определяет кислотных свойств вещества. [21]
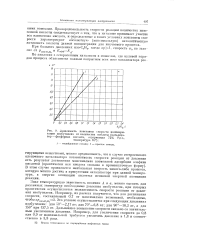 |
Зависимость константы скорости полимери. [22] |
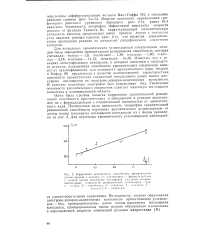
Пропорциональность скорости реакции количеству нанесенной кислоты свидетельствует о том, что в катализе принимает участие вся нанесенная кислота, и определенные в таких условиях константы скорости характеризуют абсолютную ( максимальную) каталитическую активность кислоты данной концентрации для изучаемого процесса. [23]
Катализаторами в ионном ( гетеролитичес - ком) катализе являются кислоты и основания. Каталитическая активность кислот и оснований обусловливается способностью их к о6мену реагирующей молекулой ионом или парой электронов с образованием промежуточного соединения ионного типа, обладающего высокой реакционной способностью. [24]
Катализаторами в ионном ( гетеролитическом) катализе являются кислоты и основания. Каталитическая активность кислот и оснований обусловливается способностью их к обмену реагирующей молекулой ионом или парой электронов с образованием промежуточного соединения ионного типа, обладающего высокой реакционной способностью. [25]
X, каталитическая активность кислот в реакциях общего кислотного катализа описывается уравнением Бренстеда. В соответствии с принципом БЭП, величина а должна уменьшаться по мере увеличения скорости переноса протона. [26]
Преимущества применения солей BF -, PF - или SbFg - заключаются в следующем. Эти соли не ингибируют каталитическую активность кислот Льюиса при полимеризации, тогда как катализаторы - кислоты Льюиса инак-тивируются под действием основного аниона обычных солей, таких, как галоге-ниды или сульфаты. Не образуются концевые группы, которые могут препятствовать циклизации. Можно выделять краун-эфиры пиролизом образующихся комплексов, поскольку комплексы нерастворимы в реакционных системах, а регенерируемые соли могут быть использованы снова. [27]
Преимущества применения солей BF -, PF - или SbF6 - заключаются в следующем. Эти соли не ингибируют каталитическую активность кислот Льюиса при полимеризации, тогда как катализаторы - кислоты Льюиса инак-тивируются под действием основного аниона обычных солей, таких, как галоге-ниды или сульфаты. Не образуются концевые группы, которые могут препятствовать циклизации. Можно выделять краун-эфиры пиролизом образующихся комплексов, поскольку комплексы нерастворимы в реакционных системах, а регенерируемые соли могут быть использованы снова. [28]
Так сложилась классическая теория кислотно-основного катализа, согласно которой ионы водорода и гидроксила являются единственными эффективными катализаторами. Главное положение этой теории - относительное увеличение каталитической активности кислоты или основания по мере относительного увеличения их силы ( определяемой степенью диссоциации) - хорошо согласовывалось с наблюдаемыми явлениями. [29]
Страницы: 1 2 3 4