Каталитическая активность - кислота
Cтраница 3
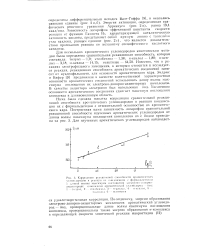
Энергия активации, определенная графическим решением уравнения Аррениуса ( рис. 2 в), равна 19 4 ккал / мол. Зависимость логарифма эффективной константы скорости реакции от функции Гаммета Но, характеризующей каталитическую активность кислоты, представляет собой прямую линию с тангенсом угла наклона, равным единице ( рис. 2 г), что является доказательством протекания реакции по механизму специфического кислотного катализа. [31]
Лапуорт был одним из первых, подвергших нападению выдвинутую Аррениусом и Оствальдом теорию каталитической активности кислот. Однако это и подобные ему исследования не произвели достаточного впечатления, пока понятие о ковалентной связи не начало ослаблять чрезмерное увлечение ионными реакциями. [32]
Энергия активации, определенная графическим решением уравнения Лррениуса ( рис. 2 в), равна 19 4 ккал / мол. Зависимость логарифма аффективной константы скорости реакции от функции Гам мета Но, характеризующей каталитическую активность кислоты, представляет собой прямую линию с тангенсом утла наклона, равным единице ( рис. 2 г), что является доказательством протекания реакции но механизму специфического кислотного катализа. [34]
В области гетеролитических каталитических реакций были установлены и первые закономерности, позволяющие предвидеть каталитическое действие. Я имею в виду установленную Оствальдом связь каталитической активности с электропроводностью растворов кислот и особенно блестящее открытие Бренстедом зависимости каталитической активности кислот и оснований от их силы, получившее столь широкое и плодотворное развитие. [35]
Исследование кинетики гидрата ] щи олефипов и дегидратации спирта в присутствии фосфорной кислоты в значительной степени осложняется тем, что вода является и реагентом и составной частью катализатора. Это приводит к тому, что как при изменении начальных давлений реагентов, так и в ходе процесса может меняться каталитическая активность кислоты. Например, вступление воды в реакцию при гидратации пропилена должно приводить к увеличению концентрации кислоты. [36]
Исследованию димеризации олефинов, в особенности бутиленов, в при - сутствии серной и фосфорной кислот посвящено большое число работ не кинетического характера. Из этих работ невозможно сделать какие-либо выводы о кинетике процесса ( порядок реакции, энергия активации), а также нельзя оценить истинные каталитические активности кислот при различных концентрациях. [37]
Каталитическая активность зависит от легкости присоединения ( или отщепления) протона к частицам. По протолитической теории все кислоты и основания могут быть катализаторами. Каталитическая активность кислот и оснований является одной из важных их особенностей. Существует прямая зависимость между силой кислот или оснований и их каталитической активностью. Каталитические реакции находят применение в качественном анализе при открытии Р, As и Si в виде комплексных гетеропо-ликислот. [38]
Теория Брюля [80], объяснявшая кето-энольное превращение в ионизирующих растворителях ионизацией энола и образованием неионизируемого кетона путем рекомбинации ионов, оказалась неудовлетворительной, так как она утверждала необратимость превращения энола в кетон. Однако эта теория; привела Лапверфа [295] к выводу, что внутреннее превращение происходит лишь у иона реагирующего органического соединения и что функция катализатора состоит в промотировании образования этих ионов. Каталитическая активность кислоты была приписана образованию реакционноспособного катиона путем обратимого присоединения водородного иона к органическому соединению. [39]
В свою очередь, для возникновения химической кинетики изучение каталитических реакций сослужило хорошую службу, как это видно уже из хронологически первой работы по химической кинетике Вильгельми. Вильгельми изучал катализируемую неорганическими кислотами инверсию тростникового сахара и высказывал надежду, что найденные им формулы могут быть применены к процессам, наступление которых приписывается действию каталитической силы. Впоследствии каталитическая активность кислот неоднократно изучалась другими химиками, в частности самим Оствальдом ( 1882 г. и ел. В 1884 г. им и Аррениусом была открыта пропорциональность между скоростью каталитических жидкофазных реакций и электропроводимостью растворов кислот - катализаторов. [40]
В свою очередь, для возникновения химической кинетики изучение каталитических реакций сослужило хорошую службу, как это ] видно уже из хронологически первой работы по химической кинетике Вильгельми. Видьгельми изучал катализируемую неорганическими кислотами инверсию тростникового сахара и высказывал надежду, что найденные им формулы могут быть применены к процессам, наступление которых приписывается действию каталитиче-ской силы. Впоследствии каталитическая активность кислот неоднократно изучалась другими химиками, в частности самим Оствальдом ( 1882 г. и ел. В 1884 г. им и Аррениусом была открыта пропорциональность между скоростью каталитических жидкофазных ре-акций и электропроводимостью растворов кислот - катализа - - торов. [41]
Авторы [620] приводят искривленные зависимости для реакций кислотно-каталитического гидролиза диазоацетатного аниона и ос-новно-каталитического депротонирования ацетилацетона. Для первой реакции точки, соответствующие катализу ОН-кислотами ( фенолами, спиртами, Н20 и Н3О) и третичными аммониевыми ионами, укладываются на разные кривые, для которых вычислены разные параметры уравнения Маркуса ( рис. VIII. Следовательно, каталитическая активность кислот определяется здесь не только значениями lg K. Кривизна зависимости для ОН-кислот всецело определяется крайними точками для Н2О и Н3О, причем последняя точка значимо отклоняется также и от приводимой в работе [620] кривой, соответствующей уравнению Маркуса. [42]
Это привело к заключению, что ионы водорода и гидроксила отличаются каталитическими свойствами. Дальнейшие исследования показали, что каталитическая активность кислот и оснований сохраняется и в неводных растворах, где электролитическая диссоциация весьма слаба. [43]
Это привело к заключению, что ионы водорода и гид-роксила отличаются каталитическими свойствами. Дальнейшие исследования показали, ЧУО каталитическая активность кислот и оснований сохраняется и в неводных растворах, где электролитическая диссоциация слаба. [44]
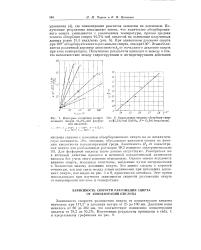 |
Изотермы абсорбции изопро - [ IMAGE ] Определение теплоты абсорбции спир-пилового спирта 94 3 % - ной фосфор - та 94 3 % - ной НзРОц. /. 15 500 ккал / моль. ной кислотой. [45] |
Страницы: 1 2 3 4